Teoria da Colisão
Lista de 10 exercícios de Química com gabarito sobre o tema Cinética: Teoria da Colisão com questões de Vestibulares.
Você pode conferir as videoaulas, conteúdo de teoria, e mais questões sobre o tema Teoria da Colisão.
01. (UFLA) A velocidade de uma reação química depende:
I. do número de colisões entre as moléculas na unidade de tempo.
II. da energia cinética das moléculas envolvidas na reação.
III. da orientação das moléculas.
Estão corretas as alternativas:
- I, II e III
- somente I
- somente II
- somente I e II
- somente I e III
02. (UFRGS) De acordo com a teoria das colisões, para ocorrer uma reação química em fase gasosa deve haver colisões entre as moléculas reagentes, com energia suficiente e com orientação adequada.
Considere as seguintes afirmações a respeito da teoria das colisões.
I - O aumento da temperatura aumenta a frequência de colisões e a fração de moléculas com energia suficiente, mas não altera a orientação das moléculas.
II - O aumento da concentração aumenta a frequência das colisões.
III - Uma energia de ativação elevada representa uma grande fração de moléculas com energia suficiente para a reação ocorrer.
Quais estão corretas?
- Apenas I.
- Apenas II.
- Apenas III.
- Apenas I e II.
- I, II e III.
03. (UFRS) As figuras a seguir representam as colisões entre as moléculas reagentes de uma mesma reação em três situações.
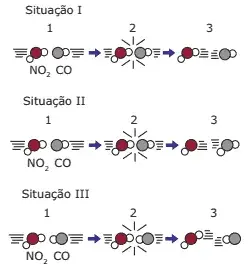
Dica: A reação em questão é NO2 + CO → NO + CO2
Pode-se afirmar que:
- na situação I, as moléculas reagentes apresentam energia maior que a energia de ativação, mas a geometria da colisão não favorece a formação dos produtos.
- na situação II, ocorreu uma colisão com geometria favorável e energia suficiente para formar os produtos.
- na situação III, as moléculas reagentes foram completamente transformadas em produtos.
- nas situações I e III, ocorreram reações químicas, pois as colisões foram eficazes.
- nas situações I, II e III, ocorreu a formação do complexo ativado, produzindo novas substâncias.
04. (PUC-RJ) Para a reação entre duas substâncias moleculares em fase gasosa, considerando a teoria das colisões, o aumento da velocidade da reação causada pela presença de um catalisador é devido:
- ao aumento instantâneo da temperatura que acelera a agitação das moléculas.
- ao aumento da taxa de colisão entre os reagentes, porém preservando a energia necessária para que a colisão gere produtos.
- à diminuição da energia de ativação para que a colisão entre as moléculas, no início da reação, gere produtos.
- ao aumento da energia de ativação que é a diferença entre a energia final dos reagentes e dos produtos.
- à diminuição da variação de entalpia da reação
05. (UESB) A partir dos estudos dos fatores que influenciam na velocidade das reações químicas, os cientistas imaginaram uma explicação simples para o modo pelo qual são desfeitas as moléculas de reagentes e são formadas as moléculas dos produtos de uma reação.
Considerando-se essas informações e com base na Teoria das Colisões, é correto afirmar que a velocidade das reações químicas dependem
- da colisão eficaz, um choque violento entre moléculas, com energia suficiente, capaz de provocar uma reação entre essas partículas.
- da menor frequência de colisões, por segundo, o que implicará maior número de moléculas formadas dos produtos durante a reação.
- da colisão não frontal, que é mais eficiente que as colisões efetivas.
- do formato trigonal plano das moléculas de reagentes, mais apropriado às colisões pequenas que envolvem energia
- da energia máxima de ativação que as moléculas devem ter para que ocorra uma colisão efetiva.
06. (UEFS) O modelo da teoria das colisões, que resultou de estudos dos fatores que influem na velocidade das reações químicas, é uma explicação para o modo como as moléculas de reagentes são clivadas e são formadas as moléculas de produtos de uma reação química.
Admitindo-se a reação química elementar entre o hidrogênio e o iodo, a 450°C, representada pela equação química, a expressão da lei de velocidade dessa reação, e com base na teoria das colisões, para que essa reação ocorra, dentre outros fatores, é preciso que
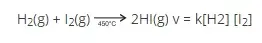
- a energia de colisão entre as moléculas de H2(g) e I2(g) seja menor que a energia de ativação.
- a orientação com a qual essas moléculas colidem forme ângulos de 180º ou de 45º entre seus eixos.
- a frequência de choque por segundo entre as moléculas de H2(g) e de I2(g) seja grande.
- as moléculas de H2(g) e de I2(g) tenham tamanhos e formas geométricas diferentes.
- as colisões efetivas entre moléculas de H2(g) e de I2(g) ocorram quando essas moléculas se encontram no estado sólido.
07. (UNIFAE) O gráfico mostra o mecanismo da reação entre o gás ozônio e o monóxido de nitrogênio, considerada elementar. De acordo com a teoria das colisões, a reação só ocorre se houver a formação do complexo ativado.
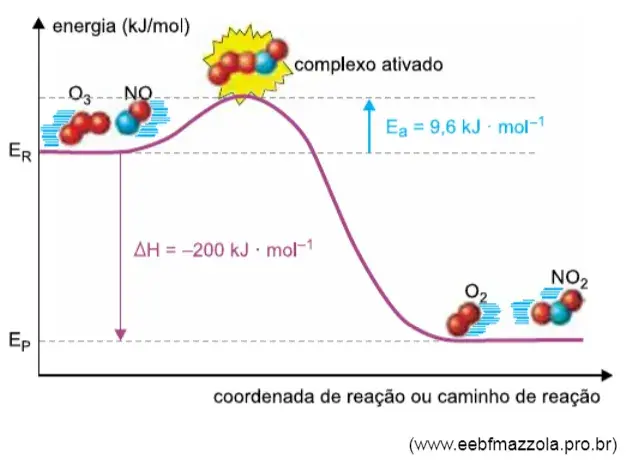
Considere a massa molar do nitrogênio = 14 g • mol–1 e do oxigênio = 16 g • mol–1. De acordo com o gráfico e a teoria das colisões, é correto afirmar que:
- a energia do complexo ativado é igual a 9,6 kJ • mol–1.
- a velocidade da reação pode ser aumentada se o valor de Ep (energia dos produtos) for aumentado.
- o aumento do valor da entalpia dos reagentes aumenta a velocidade da reação, mas não altera o valor do ΔH.
- a produção de 16 g de gás oxigênio libera 200 kJ.
- em relação ao ozônio, a reação ocorrida é de primeira ordem.
08. (IFSul) Admitindo-se que a pressão sobre os sistemas a seguir é aumentada do frasco 1 para o frasco 4, sendo que a quantidade de matéria é igual nos quatro frascos, com consequente redução do volume do recipiente, observe o esquema abaixo:
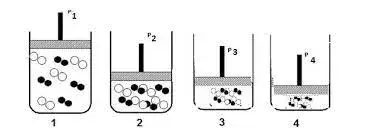
Em qual deles a velocidade da reação será maior?
- 1
- 2
- 3
- 4
09. (UNIFENAS) Observe os experimentos:
1 – Temperatura igual a 25°C.
2 – Temperatura igual a 250°C.(As demais condições são idênticas nos dois experimentos).
3 – Os dois reagentes foram utilizados na forma de pó.
4 – Os dois reagentes foram utilizados em solução aquosa. (As demais condições são idênticas nos dois experimentos).
Comparando-se as velocidades de reação em cada par de experimentos (v1 com v2; v3 comv4), é correto afirmar que:
- v2 > v1 e v3 = v4.
- v1 > v2 e v3 > v4.
- v2 > v1 e v4 > v3.
- v1 > v2 e v3 = v4
- v1 = v2 e v3 > v4.
10. (UNIT) Na temperatura ambiente, 2,4g de magnésio metálico, Mg, foram colocados em contato com água. Ao meio foram adicionadas duas gotas de fenolftaleína e observou-se a ocorrência de uma lenta reação, em que foi verificado que o meio ficou rosa, um indicativo de que houve formação de íons OH− no processo. No mesmo momento, 2,3g de sódio metálico, Na, foram adicionados a um recipiente contendo o mesmo volume de água e observou-se uma reação violenta, na qual também houve indícios da formação de ânions hidroxila.
Sobre essas reações, é correto afirmar:
- A reação envolvendo o sódio metálico possui uma menor energia de ativação em relação àquela envolvendo o magnésio.
- Já era esperado que a reação envolvendo o sódio teria menor tempo, uma vez que a massa utilizada do metal foi menor do que para o magnésio.
- Em ambas as reações, o número de colisões efetivas entre as partículas dos reagentes vai aumentando à medida que a reação se processa.
- Um aumento na temperatura do meio faria com que o número de colisões efetivas fosse menor, o que aumentaria a velocidade das reações.
- Se o magnésio tivesse sido triturado, a reação teria se processado em um tempo menor, já que haveria uma diminuição na superfície de contato das partículas do metal.