Aspectos Quantitativos das Soluções: VI
Lista de 10 exercícios de Química com gabarito sobre o tema Aspectos Quantitativos das Soluções: (Fórmulas Estruturais) com questões de Vestibulares.
Você pode conferir as videoaulas, conteúdo de teoria, e mais questões sobre o tema Aspectos Quantitativos das Soluções: .
01. (Uece) Suponha que 500 ml de solução de iodeto de potássio, com concentração em quantidade de matéria de 1,0 mol/L, reajam com nitrato de chumbo II, conforme a reação:
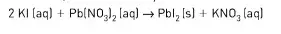
O iodeto de chumbo II produzido tem massa, aproximadamente, igual a:
- 57,63 g
- 115,25 g
- 166,00 g
- 230,50 g
02. (UFES) Em diabéticos, a ingestão de 80 g de açúcar comum (sacarose) eleva a quantidade de glicose no sangue em 1,0 g de glicose para cada litro de sangue.
Considerando-se que a taxa de glicose no sangue dos diabéticos, em condições normais, é de aproximadamente 1,4 g/L, a concentração de glicose (C6H1206) no sangue de uma pessoa diabética após o consumo de 100 g de açúcar será de, aproximadamente:
(Dado: M(C6H1206) = 180 g/mol.)
- 7,8 • 10-3 mol/L
- 6,9 • 10-3 mol/L
- 6, 9 · 10-2 mol/L
- 1,5 · 10-2 mol/L
- 1,5 · 10-1 mol/L
03. (UFRGS) Soluções de ureia, (NH2)2CO, massa molar 60 g/mol, podem ser utilizadas como fertilizantes. Uma solução foi obtida pela mistura de 210 g de ureia e 1 000 g de água.
A densidade da solução final é 1,05 g/ml. A concentração da solução em percentual de massa de ureia e em mol/L, respectivamente, é:
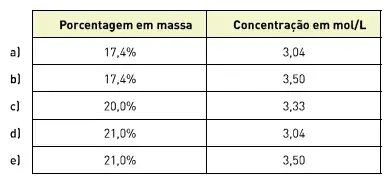
04. (PUC-MG) Uma solução de hidróxido de alumínio (MM = 78 g · mol · L-1), utilizada no combate à acidez estomacal, apresenta uma concentração igual a 3, 90 g · L-1.
A concentração, em mol · L-1, dos íons hidroxila (OH-). presentes nessa solução, é igual a:
- 5,0 · 10-1
- 1,5 • 10-1
- 1,5 • 10-2
- 5,0 • 10-2
05. (PUC-RS) Analise as concentrações dos íons abaixo, que estão expressas, em mmol/L, no rótulo de uma amostra de leite
1 – Potássio (K+) = 35,3
2 – Sódio (Na+) = 25,2
3 – Cálcio (Ca2+) = 30,1
A ordem crescente das concentrações dos íons presentes no leite, em mg/L, é
- 1, 2, 3
- 1, 3, 2
- 2, 1, 3
- 2, 3, 1
- 3, 1, 2
06. (UFLA) Soluções de sulfato de cobre pentaidratado (CuS04 • 5 H20) são utilizadas na agricultura para combater fungos parasitas das plantas e fornecer o nutriente cobre aos vegetais por meio de pulverização.
Uma solução contendo 1O g desse sal por litro de solução (1% p/v) é utilizada com grande frequência. A concentração dessa solução em mol/L ou M equivale a:
(Massa molar do CuS04 • 5H20 = 250 g/mol.)
- 0,40
- 4,00
- 0,04
- 2,50
- 1,00
07. (Unesp) O etanotiol (CH3CH2 - SH) é uma substância tóxica e tem um odor tão forte que uma pessoa pode detectar 0,016 mal disperso em 5,0 - 1010g de ar. Sabendo-se que a densidade do ar é 1,25 g/L e supondo distribuição uniforme do etanotiol no ar, a quantidade limite, em mol/L, que uma pessoa pode detectar é
- 1,6 • 10-2
- 2,0 • 10-11
- 2,5 • 10-11
- 4,0 • 10-13
- 1,0 • 10-23
08. (UFSM) Os refrigerantes energéticos ingeridos pelos atletas contêm uma grande variedade de íons (Na+, K+, cℓ-), essenciais para manter o equilíbrio eletrolítico dos fluidos do corpo.
Considerando que essa bebida contenha 0,2222% (massa/volume) de CaCℓ2 e densidade da solução de 1 g/ml, a concentração molar dos íons cloreto (cℓ-) será, aproximadamente, de:
- 0,02 M
- 0,04 M
- 0,06 M
- 0,20 M
- 0,69 M
09. (UFG) A água oxigenada é vendida como uma solução de peróxido de hidrogênio (H2O2) em água (H2O). O peróxido se decompõe lentamente em O2 e H2O.
Essa solução apresenta uma concentração medida em volumes (V), ou seja, 1 L de solução de água oxigenada 10 V é capaz de liberar 10 L de O2, a 0°C e 1 atm, quando decomposta.
Assim, pode-se afirmar que o número de mols de O2 produzidos pela decomposição de 1 L de uma solução de água oxigenada 20 V é
- 0,04
- 0,45
- 0,89
- 1,12
- 17,8
10. (UFMG) Um frasco que contém 1 litro de água oxigenada, H202 (aq), na concentração de 1 mol/L, foi armazenado durante um ano.
Após esse período, verificou-se que 50% dessa água oxigenada se tinha decomposto, como mostrado nesta equação:
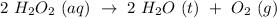
Considerando-se essas informações, é correto afirmar que a massa de oxigênio produzida nesse processo é:
- 8 g
- 16 g
- 17 g
- 32 g