Bateria ou Pilha de Lítio-iodo
Lista de 10 exercícios de Química com gabarito sobre o tema Bateria ou Pilha de Lítio-iodo com questões de Vestibulares.
Você pode conferir as videoaulas, conteúdo de teoria, e mais questões sobre o tema Bateria ou Pilha de Lítio-iodo.
01. (Unifesp) A bateria primária de lítio-iodo surgiu em 1967, nos Estados Unidos, revolucionando a história do marca-passo cardíaco. Ela pesa menos que 20g e apresenta longa duração, cerca de cinco a oito anos, evitando que o paciente tenha que se submeter a frequentes cirurgias para trocar o marca-passo. O esquema dessa bateria é representado na figura.
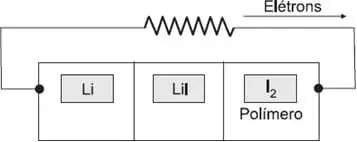
Para esta pilha, são dadas as semirreações de redução:
Li+ + e– → Li Eº= – 3,05 V
I2. + 2e– → 2I– Eº= + 0,54 V
São feitas as seguintes afirmações sobre esta pilha:
I. No ânodo ocorre a redução do íon Li+.
II. A ddp da pilha é + 2,51 V.
III. O cátodo é o polímero/iodo.
IV. O agente oxidante é o I2.
São corretas as afirmações contidas apenas em:
- I, II e III.
- I, II e IV.
- I e III.
- II e III.
- III e IV.
02. (UDESC) As baterias de lítio-iodo foram desenvolvidas principalmente para serem utilizadas em marcapassos cardíacos, por serem leves, seguras (não liberam gases, pois são fechadas hermeticamente), possuem boa durabilidade (estimada em 8 a 10 anos), e fornecem uma alta densidade de carga (0,8 Wh/cm3). Com relação à bateria de lítio-iodo, abaixo estão apresentadas as semirreações, juntamente com seus potenciais padrões.
Semirreação (A): Li+(s) + e- → Li(s) Eº = - 3,05 V
Semirreação (B): I2(s) + 2e-→ 2 I-(s) Eº = + 0,54 V
Assinale a alternativa correta em relação às semirreações acima.
- A semirreação (A) acontece no cátodo, a semirreação (B) acontece no ânodo. Desta maneira, na semirreação (A) ocorre oxidação e na semirreação (B) ocorre redução.
- O lítio metálico é o agente redutor, e o potencial padrão para a bateria vale -3,59 V.
- A reação global é: 2 Li2 + 2 I22 → 2 LiI2, com potencial padrão de + 2,51 V.
- Conforme os potenciais padrões apresentados para a as semirreações, a diferença de potencial desta bateria é, em condições padrão, Eº = - 2,51 V.
- No sentido espontâneo, a semirreação (A) acontece no ânodo, a semirreação (B) acontece no cátodo. Desta maneira, na semirreação (A) ocorre oxidação e na semirreação (B) ocorre redução.
03. (USF) A ciência médica encontrou uma maneira de corrigir os problemas de “coração lento”, por meio do implante de marca-passo cardíaco artificial. Esse aparelho é um dispositivo eletrônico composto de gerador (pilha do marca-passo) e eletrodo (fio que se comunica com o coração). Uma das pilhas utilizadas é a de lítio-iodo, que pode funcionar continuamente por até dez anos e, por não formar gases, pode ser fechada hermeticamente.
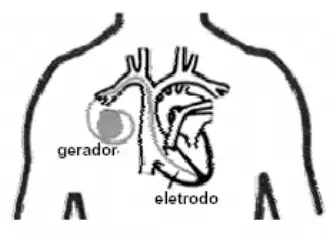
Considere as seguintes semirreações de redução:
Li+ + e- → Li E° = -3,05V
L2+ + 2e- → 2I- E° = -0,54V
Com base nas afirmações feitas sobre a pilha de lítio-iodo, assinale a alternativa correta.
- A reação global da pilha é 2 Li+ + I2 → 2Li + 2I-.
- No anodo ocorre a oxidação do I2.
- O eletrodo de menor potencial-padrão de redução recebe elétrons, sofrendo redução.
- O agente oxidante é o I2.
- O catodo é o eletrodo de lítio.
04. (EMESCAM) A eletroquímica é um ramo da Química que estuda os processos de transferência de elétrons nas reações espontâneas de oxidação / redução. No campo da Medicina, a eletroquímica está presente especialmente no uso das pilhas de lítio ou lítio-iodo, para o funcionamento de marca-passos implantados no interior da caixa torácica do indivíduo, a fim de controlar os batimentos cardíacos por meio de impulsos elétricos. Os eletrodos das baterias de lítio-iodo são formados por lítio e um complexo de iodo, que ficam separados por meio de uma camada cristalina de iodeto de lítio que permite a passagem de corrente elétrica.
As semirreações dos potenciais de redução estão descritas a seguir.
Li+(s) + e– → Li(s) Eº = –3,05 V
I2(s) + 2e– → 2 I- (s) Eº = +0,53 V
Com base nesses dados, analise as seguintes afirmativas.
I. A reação catódica é uma reação de oxidação que libera elétrons, proporcionando a corrosão do lítio.
II. O processo de oxidação do iodo será espontâneo.
III. O eletrodo de lítio será o polo negativo da pilha e sofrerá corrosão.
IV. A reação global da pilha ocorrerá com a decomposição do iodeto de lítio formando iodo molecular e íons lítio.
Estão incorretas as afirmativas
- I, II e IV, apenas.
- II, III e IV, apenas.
- I e II, apenas.
- II e III, apenas.
05. (UCPEL) Os marca-passos cardíacos se utilizam de pilhas de lítio que são bastante leves, seguras e de boa durabilidade. São feitas de lítio e iodo que apresentam os seguintes potenciais de redução, respectivamente: - 3,04V e +0,54V. De acordo com essas informações, sobre essa pilha é correto afirmar que
- apresenta uma diferença de potencial de 2,50 V.
- o lítio age como agente oxidante e é o polo negativo.
- o lítio é o ânodo pois sofre redução.
- os elétrons migram do iodo para o lítio.
- o iodo é o cátodo e polo positivo.
06. (CESMAC) As pilhas de lítio-iodo possuem o formato de moedas pequenas e foram desenvolvidas principalmente para serem usadas em marca-passos cardíacos, já que são bem leves, seguras, têm uma boa durabilidade (cerca de 8 a 10 anos) e fornecem uma voltagem de 2,8 V. Os eletrodos são formados por lítio e um complexo de iodo, que ficam separados por meio de uma camada cristalina de iodeto de lítio que permite a passagem da corrente elétrica.
A reação que ocorre numa bateria de lítio-iodo é representada pela equação:
2 Li(s) + I2(s) → 2 LiI(s)
Analisando a reação redox acima, é correto afirmar que:
- o lítio metálico sofre redução e, portanto, é o cátodo.
- o número de oxidação (NOX) do iodo no I2 é -1.
- 1 mol de lítio metálico libera 1 mol de elétrons.
- o NOX do iodo varia de zero para +1.
- o I2 é o agente redutor.