Pilhas
Lista de 10 exercícios de Química com gabarito sobre o tema Pilhas com questões de Vestibulares.
Você pode conferir as videoaulas, conteúdo de teoria, e mais questões sobre o tema Pilhas.
01. (Unesp) A equação seguinte indica as reações que ocorrem em uma pilha:
Zn(s) + Cu2+(aq) → Zn2+(aq) + Cu(s)
Podemos afirmar que:
- O zinco metálico é o cátodo.
- O íon cobre sofre oxidação.
- O zinco metálico sofre aumento de massa.
- O cobre é o agente redutor.
- Os elétrons passam dos átomos de zinco metálico aos íons de cobre.
02. (CESGRANRIO-RJ) Considere a pilha representada abaixo.
Cu(s)/ Cu2+ || Fe3+, Fe2+ / Pt(s)
Assinale a afirmativa falsa.
- A reação de redução que ocorre na pilha é: Cu2+ + 2 e– → Cu(s)
- O eletrodo de cobre é o ânodo.
- A semi-reação que ocorre no cátodo é Fe3+ + e– → Fe2+.
- A reação total da pilha é: 2 Fe3+ + Cu → 2 Fe2+ + Cu2+.
- Os elétrons migram do eletrodo de cobre para o eletrodo de platina
03. (PUC-RIO) Considere o esquema abaixo que representa uma pilha constituída de metal cobre em solução aquosa de sulfato de cobre e metal cádmio em solução de sulfato de cádmio.
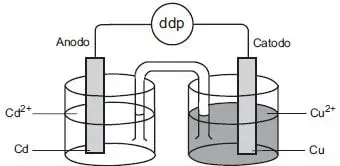
Uma tabela fornece a informação de que os potenciais padrões de redução do Cu2+ e do Cd2+ são, respectivamente, +0,34 V e -0,40 V e que a prata é um elemento mais nobre que o cobre. Assinale a opção que mostra a ordem decrescente de facilidade de oxidação dos três metais citados e a diferença de potencial (ddp) da pilha indicada na figura.
- Cu > Ag > Cd; -0,74 V
- Cd > Cu > Ag; +0,74 V
- Ag > Cu > Cd; -0,06 V
- Cd > Cu > Ag; +0,06 V
- Ag > Cd > Cu; -0,74 V
04. (UNIFESP-SP) Ferro metálico reage espontaneamente com íons Pb2+, em solução aquosa. Esta reação é representada por:
Fe + Pb2+ → Fe2+ + Pb
Na pilha representada pela figura

Em que ocorre aquela reação global,
- os cátions devem migrar para o eletrodo de ferro.
- ocorre deposição de chumbo metálico sobre o eletrodo de ferro.
- ocorre diminuição da massa do eletrodo de ferro.
- os elétrons migram através da ponte salina do ferro para o chumbo.
- o eletrodo de chumbo atua como ânodo.
05. (UDESC) Uma pilha de Daniell opera em condições padrões com soluções aquosas de ZnSO4 e CuSO4, com diferença de potencial nos terminais de ΔE0. Cristais de CuSO4 são adicionados na respectiva solução, alterando o potencial para ΔE, na mesma temperatura.
Pode-se afirmar que este novo potencial:
- permaneceu constante.
- mentou.
- diminuiu.
- ficou zero.
- não pode ser calculado.
06. (UFPE) Considere uma cela galvânica formada por semicelas-padrão de cobre e de zinco, cujos potenciais de redução são os seguintes:
Cu2+ + 2 e– → Cu Eº = + 0,34 V
Zn2+ + 2 e– → Zn Eº = – 0,76 V
É correto afirmar que:
- os elétrons no circuito externo fluirão do eletrodo de cobre para o eletrodo de zinco.
- o potencial-padrão da cela é – 0,42 V.
- quando o equilíbrio for atingido não haverá diferença de potencial entre os eletrodos.
- os íons zinco são reduzidos a zinco metálico.
- o eletrodo de cobre é o cátodo.
07. (MACK) Em uma pilha com eletrodos de zinco e de cobre, com circuito fechado, ocorre:
- o potencial do eletrodo de zinco diminui e o do cobre aumenta;
- o potencial do dois eletrodos diminui;
- o potencial do eletrodo de zinco aumenta e o do cobre diminui;
- o potencial dos dois eletrodos aumenta;
- o potencial dos dois eletrodos não se altera.
08. (Fuvest) Numa pilha do tipo comumente encontrado nos supermercados, o pólo negativo é constituído pelo revestimento externo de zinco. A semi-reação que permite ao zinco funcionar como pólo negativo é:
- Zn+ + e- → Zn
- Zn2+ + 2e- → Zn
- Zn → Zn+ + e-
- Zn → Zn2+ + 2e-
- Zn2+ + Zn → 2Zn+
09. (FURRN) Na pilha eletroquímica Zn0 / Zn2+ // Cu2+ / Cu0, ocorrem reações de oxirredução. Nesse sistema, pode-se afirmar que:
- no polo negativo há oxidação de Cu0 a Cu2+.
- no polo negativo há oxidação de Zn0 a Zn2+.
- no polo positivo há oxidação de Cu0 a Cu2+.
- no polo positivo há oxidação de Zn0 a Zn2+.
- no polo positivo há redução de Zn2+ a Zn0.
09. (UEMA) Um professor, preocupado em estimular a curiosidade de seus alunos, para a observação dos fenômenos de transferência de elétrons, utiliza um experimento de construção de uma pilha galvânica. Analise a figura que o ilustra.
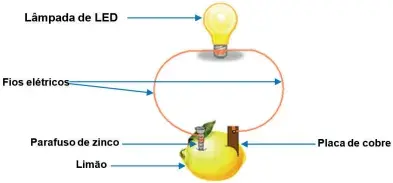
O material utilizado é de fácil obtenção, o que possibilita a apresentação do experimento numa feira de ciências na escola.
https://educador.brasilescola.uol.com.br/estrategias-ensino/pilhas-caseiras.htm.
Uma pilha ou célula galvânica pode ser caracterizada como um processo espontâneo no qual a energia química é transformada em energia elétrica. Dessa forma, a pilha fornece energia para um determinado sistema (uma lâmpada, por exemplo) até que a reação química se esgote.
O experimento proposto pelo professor funciona do mesmo modo que uma pilha comercial pelo fato de que
- o limão atua como um excelente catalisador da reação entre os metais.
- o limão transmite a sua energia calórica armazenada para a lâmpada.
- os dois metais, cravados no limão, apresentam uma diferença de potencial entre si.
- a placa e o parafuso são oxidados pela acidez do limão, liberando energia.
- a lâmpada e o limão, ânodo e cátodo, respectivamente, são os dois polos da pilha.