Propriedades Físico-químicas
Lista de 15 exercícios de Química com gabarito sobre o tema Propriedades Físico-químicas com questões de Vestibulares.
Você pode conferir as videoaulas, conteúdo de teoria, e mais questões sobre o tema Propriedades Físico-químicas.
1. (UFRN) Consertando sua bicicleta, um estudante sujou de graxa a camisa. Na aula de Química, procurou saber como limpar aquela macha. O professor não respondeu diretamente: apenas informou que a graxa lubrificante era uma mistura de hidrocarbonetos alifáticos, cuja solubilidade diminui com o aumento da polaridade do solvente.
Dispondo de acetona (CH3COCH3), álcool comum (CH3CH2OH) e benzina (C6H6), o rapaz verificou que a solubilidade da graxa nessas substâncias crescia na seguinte ordem:
- acetona, benzina e álcool
- benzina, álcool e acetona
- álcool, acetona e benzina
- álcool, benzina e acetona
2. (UFES) O etanol se mistura com a água em qualquer proporção. Outra característica do etanol é que ele apresenta uma parte apolar em sua molécula e, por isso, também se dissolve em solventes apolares.
Dados ao álcoois
I. butan-2-ol,
II. hexan-1-ol,
III. propan-1-ol,
IV. octan-1-ol,
a opção que representa CORRETAMENTE a ordem crescente de solubilidade em água dos álcoois acima é
- II, IV, III, I
- III, I, II, IV
- III, II, I, IV
- IV, II, I, III
- IV, II, III, I
3. (UFMG) Em relação ao aldeído acético e ao ácido acético, todas as afirmativas estão corretas, EXCETO
- As moléculas do ácido acético possuem um átomo de oxigênio a mais do que as de aldeído acético.
- As moléculas do aldeído acético formam ligações intermoleculares mais intensas do que as do ácido acético.
- O aldeído acético é um redutor mais forte do que o ácido acético.
- O pH de uma solução de ácido acético é menor do que o de uma solução de aldeído acético.
- A temperatura de ebulição do ácido acético é maior do que o do aldeído acético.
04. (Fuvest) Ao se preparar molho de tomate (considere apenas a fervura de tomate batido com água e azeite), é possível observar que a fração aquosa (fase inferior) fica vermelha logo no início e a fração oleosa (fase superior), inicialmente com a cor característica do azeite, começa a ficar avermelhada conforme o preparo do molho. Por outro lado, ao se preparar uma sopa de beterraba (considere apenas a fervura de beterraba batida com água e azeite), a fração aquosa (fase inferior) fica com a cor rosada e a fração oleosa (fase superior) permanece com sua coloração típica durante todo o processo, não tendo sua cor alterada.
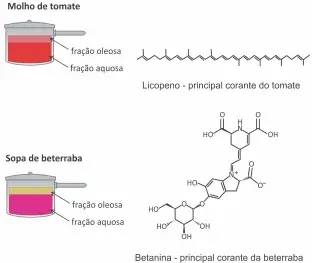
Considerando as informações apresentadas no texto e no quadro, a principal razão para a diferença de coloração descrita é que a fração oleosa
Note e adote:
Massas molares (g/mol):
Licopeno = 537; betanina = 551.
- fica mais quente do que a aquosa, degradando a betanina; o mesmo não é observado com o licopeno, devido à sua cadeia carbônica longa.
- está mais exposta ao ar, que oxida a betanina; o mesmo não é observado com o licopeno, devido à grande quantidade de duplas ligações.
- é apolar e a betanina, polar, havendo pouca interação; o mesmo não é observado com o licopeno, que é apolar e irá interagir com o azeite.
- é apolar e a aquosa, polar, mantendo‐se separadas; o licopeno age como um surfactante misturando as fases, colorindo a oleosa, enquanto a betanina não.
- tem alta viscosidade, facilitando a difusão do licopeno, composto de menor massa molar; o mesmo não é observado para a betanina, com maior massa.
05. (UNICAMP) O Termômetro de Galileu (Figura A) é uma forma criativa de se estimar a temperatura ambiente. Ele consiste em uma coluna de vidro preenchida com um líquido. Em seu interior, são colocadas várias bolas de vidro colorido calibradas e marcadas para a leitura da temperatura. As bolas de vidro sobem ou descem em função da temperatura. A sensibilidade do Termômetro de Galileu reside na sua capacidade de separar duas leituras de temperaturas. A figura B é um gráfico de densidade em função da temperatura para água e etanol, dois líquidos que poderiam ser usados no termômetro.
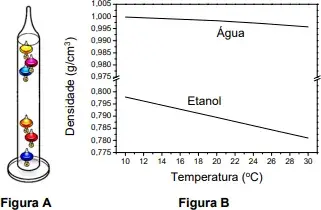
De acordo com essas informações e os conhecimentos de química, a leitura correta da temperatura do termômetro representado na Figura A pode ser indicada pela bola de vidro que se situa
- mais abaixo entre as que se encontram na parte de cima do tubo, sendo que a água proporcionaria um termômetro mais sensível.
- mais acima entre as que se encontram na parte de baixo do tubo, sendo que a água proporcionaria um termômetro mais sensível.
- mais acima entre as que se encontram na parte de cima do tubo, sendo que o etanol proporcionaria um termômetro mais sensível.
- mais abaixo entre as que se encontram na parte de cima do tubo, sendo que o etanol proporcionaria um termômetro mais sensível.
06. (UFJF) O cloreto de hidrogênio é um gás em temperatura ambiente, bastante solúvel em água, mas que pode ser liquefeito quando puro, se resfriado abaixo de -85°C.
Sobre este composto e suas soluções aquosas, assinale a alternativa CORRETA:
- O cloreto de hidrogênio puro, no estado líquido, é um bom condutor de eletricidade, pois contém íons H+ e Cl- .
- O cloreto de hidrogênio puro, no estado líquido, conduz a eletricidade devido à baixa temperatura.
- Em uma solução aquosa de cloreto de hidrogênio a água age como uma base, e a solução resultante conduz eletricidade.
- A solução aquosa de cloreto de hidrogênio contém números iguais de íons H+ e Cl- , sendo, portanto eletricamente neutra e não condutora de eletricidade.
- Em uma solução aquosa de cloreto de hidrogênio a água age como uma base, o que neutraliza a solução, tornando-a não condutora de eletricidade.
07. (UNICAMP) As empresas que fabricam produtos de limpeza têm se preocupado cada vez mais com a satisfação do consumidor e a preservação dos materiais que estão sujeitos ao processo de limpeza. No caso do vestuário, é muito comum encontrarmos a recomendação para fazer o teste da firmeza das cores para garantir que a roupa não será danificada no processo de lavagem. Esse teste consiste em molhar uma pequena parte da roupa e colocála sobre uma superfície plana; em seguida, coloca-se um pano branco de algodão sobre sua superfície e passa-se com um ferro bem quente. Se o pano branco ficar manchado, sugere-se que essa roupa deve ser lavada separadamente, pois durante esse teste ocorreu um processo de
- fusão do corante, e o ferro quente é utilizado para aumentar a pressão sobre o tecido.
- liquefação do corante, e o ferro quente é utilizado para acelerar o processo.
- condensação do corante, e o ferro quente é utilizado para ajudar a sua transferência para o pano branco.
- dissolução do corante, e o ferro quente é utilizado para acelerar o processo.
08. (UFJF) Considere os vários tipos de ligações químicas possíveis e sua influência nas propriedades físicoquímicas das substâncias.
Assinale a alternativa que contenha a afirmativa CORRETA:
- O tetracloreto de carbono (CCl4) é uma substância iônica e sua solução aquosa conduz eletricidade.
- O cobre é uma substância molecular e tende a conduzir eletricidade no estado sólido.
- Substâncias metálicas como o He não formam ligações entre si.
- Substâncias moleculares tendem a ter pontos de ebulição maiores do que compostos iônicos.
- Substâncias moleculares como metanol (CH3OH) contêm ligações covalentes e não são boas condutoras de eletricidade.
09. (UFMG) Um estudante adicionou uma colher de bicarbonato de sódio em um copo contendo uma solução fria de vinagre e observou a liberação de bolhas de gás.
Em seguida, foram formuladas as seguintes hipóteses:
I – Todo o gás liberado estava retido nos pequenos espaços entre os cristais de bicarbonato de sódio.
II – A liberação das bolhas de gás ocorrerá mais rapidamente com o uso de uma solução morna de vinagre.
III – Ao término do experimento, após a evaporação do líquido do copo, é possível obter a mesma quantidade de bicarbonato utilizado inicialmente.
É CORRETO afirmar que apenas
- a hipótese I é verdadeira.
- a hipótese II é verdadeira.
- as hipóteses I e II são verdadeiras.
- as hipóteses II e III são verdadeiras.
10. (UNICAMP) “Ferro Velho Coisa Nova” e “Compro Ouro Velho” são expressões associadas ao comércio de dois materiais que podem ser reaproveitados. Em vista das propriedades químicas dos dois materiais mencionados nas expressões, pode-se afirmar corretamente que
- nos dois casos as expressões são apropriadas, já que ambos os materiais se oxidam com o tempo, o que permite distinguir o “novo” do “velho”.
- nos dois casos as expressões são inapropriadas, já que ambos os materiais se reduzem com o tempo, o que não permite distinguir o “novo” do “velho”.
- a primeira expressão é apropriada, pois o ferro se reduz com o tempo, enquanto a segunda expressão não é apropriada, pois o ouro é um material inerte.
- a primeira expressão é apropriada, pois o ferro se oxida com o tempo, enquanto a segunda expressão não é apropriada, pois o ouro é um material inerte.
11. (UDESC) A água é o principal componente dos organismos vivos. A movimentação dela entre os seus diversos compartimentos é constituída de processos de transferência. Analise os processos de transferência.
I. precipitação
II. dissolução
III. escoamento
IV. eutrofização
V. evaporação
Assinale a alternativa correta.
- Somente as afirmativas II, III e V são verdadeiras.
- Somente as afirmativas I, III e V são verdadeiras.
- Somente as afirmativas I e V são verdadeiras.
- Somente as afirmativas II, III, IV e V são verdadeiras.
- Somente as afirmativas I, II e III são verdadeiras.
12. (UEA) Constituem um fenômeno físico e um fenômeno químico
- a fotossíntese vegetal e o congelamento de um peixe, respectivamente.
- o deslizamento de terra e a filtração de uma água barrenta, respectivamente.
- a formação do orvalho e a combustão da lenha, respectivamente.
- o cozimento de um ovo e a fritura de um bife, respectivamente.
- a ebulição da água e o derretimento de um sorvete, respectivamente.
13. (PUC-PR) As substâncias orgânicas com propriedades semelhantes são agrupadas pelo grupo funcional que apresentam, independentemente da estrutura. O que define as características dos diferentes compostos orgânicos é a função química a que eles pertencem. A seguir são feitas algumas afirmativas sobre substâncias orgânicas:
I. O butano, principal componente do gás de cozinha, pertence à função química hidrocarboneto e apresenta em sua estrutura apenas carbonos com hibridação sp3.
II. O etanol, muito comum em bebidas alcoólicas e amplamente usado como combustível, pertence à função química aldeído.
III. A propanona, conhecida comumente como acetona, usada como removedor de esmaltes, pertence à função química ácido carboxílico.
IV. O butanoato de etila, que simula o cheiro artificial do abacaxi, pertence à função química éter e sua cadeia carbônica é classificada como alifática e heterogênea.
V. O etóxi-etano é um líquido incolor, pertence à função química éter, é volátil e muito inflamável; seus vapores são tóxicos e antigamente era usado como anestésico.
Estão corretas APENAS:
- I, IV e V.
- II, IV e V.
- I, II e III.
- I e V.
- I e IV.
14. (UFRGS) O Prêmio Nobel de Química 2017 foi concedido aos pesquisadores Joachim Frank, Richard Henderson e Jacques Dubochet pelo desenvolvimento da técnica de microscopia eletrônica criogênica, permitindo a visualização tridimensional de biomoléculas. A técnica consiste no resfriamento rápido, abaixo de -135 ºC, da água intracelular, levando à formação de um sólido não cristalino, denominado “água vitrificada”.
Considere as afirmações abaixo, sobre os estados físicos da água.
I - A água, na temperatura ambiente, é líquida devido às ligações de hidrogênio entre suas moléculas.
II - A água, abaixo de 0°C, cristaliza, mantendo a mesma densidade da água líquida.
III- O resfriamento rápido da água, empregado no método da microscopia eletrônica criogênica, evita a formação de cristais e mantém a integridade celular.
Quais estão corretas?
- Apenas I.
- Apenas II.
- Apenas III.
- Apenas I e III.
- I, II e III.
15. (ITA) Assinale a opção CORRETA para a propriedade físico-química cujo valor diminui com o aumento de forças intermoleculares.
- Tensão superficial
- Viscosidade
- Temperatura de ebulição
- Temperatura de solidificação
- Pressão de vapor