Bases ou Hidróxidos
Lista de 10 exercícios de Química com gabarito sobre o tema Bases ou Hidróxidos com questões de Vestibulares.
Você pode conferir as videoaulas, conteúdo de teoria, e mais questões sobre o tema Bases ou Hidróxidos.
01. (URCA) As donas de casa usam no dia a dia inúmeras substâncias químicas em suas residências nos afazeres domésticos. Umas das substâncias que é utilizada pelas donas de casa é a soda cáustica, utilizadas para desentupir as pias e ralos de cozinhas. Sobre a soda cáustica é correto afirmar.
- É um produto extremamente corrosivo devido a sua forte acidez.
- Tem um caráter muito alcalino, mas não é corrosivo.
- Provoca queimaduras na pele e deve ser usado com muito cuidado mesmo em ambiente doméstico.
- Pode ser obtida por processos de cristalização da água em ambientes marinhos.
- Sua facilidade em dissolver gorduras nos ralos e pias deve-se ao fato da mesma ser uma substância muito volátil.
02. (URCA) Um agrônomo analisando um determinado tipo de solo percebeu que o mesmo estava com uma acidez muito elevada. Com base nestas informações qual das substâncias abaixo poderia ser utilizada na correção da elevada acidez deste solo?
- NaCl
- CaCO3
- H2O2
- D) H2O
- Ni(NO3)2
03. (Unioeste) Os hidróxidos de sódio, cálcio, alumínio e magnésio são bases utilizadas com diferentes números de hidroxilas. Assinale a alternativa que define corretamente estas bases na sequência indicada.
- Monobase, dibase, dibase e monobase.
- Monobase, monobase, tribase e dibase.
- Dibase, dibase, tribase e dibase.
- Tribase, monobase, monobase e monobase.
- Monobase, dibase, tribase e dibase.
04. (ACAFE) Considere soluções aquosas saturadas de hidróxido de cálcio e de hidróxido de alumínio ambas na mesma temperatura.
Dados: Para a resolução dessa questão considere os seguintes produtos de solubilidade (Ks) em água: Ks Ca(OH)2 = 4.10-6, Ks Al(OH)3 = 1.10-33
Nesse sentido é correto afirmar, exceto:
- O pH da solução saturada de hidróxido de alumínio é menor que o pH da solução saturada de hidróxido cálcio.
- O hidróxido de cálcio é mais solúvel em água que o hidróxido de alumínio.
- O pH da solução saturada de hidróxido de cálcio é menor que o pH da solução saturada de hidróxido alumínio.
- Na solução saturada de hidróxido de cálcio a concentração dos íons hidroxilas é 2.10-2 mol/L.
05. (UFAM PSC) O hidróxido de sódio (NaOH), muito conhecido como soda cáustica, é produzido pela eletrólise da salmoura bruta obtida por dissolução de sal marinho ou de jazidas subterrâneas (sal-gema) em água. É amplamente empregado na fabricação de sabões e detergentes, de fibras e de plásticos, de vidros, de substâncias petroquímicas, de polpa de madeira e papel, de fertilizantes, explosivos e solventes, dentre outras. Sua classificação química como base forte é responsável pelas suas diversas aplicações porque:
- não se dissolve na água.
- reage para formar cristais de sal em água..
- não conduz corrente elétrica.
- não reage com ácidos.
- facilmente libera íons hidróxido
06. (UESB) O hidróxido de cálcio, conhecido como cal hidratada ou extinta, é um sólido branco pouco solúvel em água, utilizado na preparação de argamassa e na pintura de paredes. No tratamento de água e de esgotos, participa como regulador de pH e floculante.
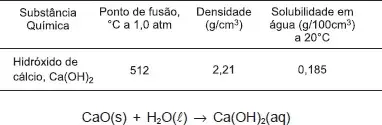
Considerando-se as informações da tabela, da equação química e do texto, é correto afirmar:
O hidróxido de cálcio, conhecido como cal hidratada ou extinta, é um sólido branco pouco solúvel em água, utilizado na preparação de argamassa e na pintura de paredes. No tratamento de água e de esgotos, participa como regulador de pH e floculante. Considerando-se as informações da tabela, da equação química e do texto, é correto afirmar:
- O íon OH−(aq) é base conjugada do íon Ca2+(aq) quando em solução aquosa, de acordo com os conceitos de ácido e de base de Brönsted-Lowry.
- A mistura de 1,0g de hidróxido de cálcio com 100cm3 de água, após agitação e atingir o equilíbrio químico, forma uma solução diluída da base.
- O aumento do pH, com a diminuição da acidez pela adição de hidróxido de cálcio, promove a formação e a floculação de Al(OH)3 no tratamento de água e de esgotos.
- A carga de 5m3 de cal hidratada, transportada por uma caçamba, corresponde a de 9 toneladas de óxido de cálcio.
- O hidróxido de cálcio é um sólido covalente, que, na argamassa, na pintura e na presença de dióxido de carbono, forma um hidroxi-sal de fórmula Ca(OH)CO3.
07. (UFRN) Leia as informações contidas na tirinha abaixo.

Uma substância que pode ser incluída no cardápio de antiácidos por ter propriedades básicas é
- NaF.
- CaCl2.
- Mg(OH)2.
- CH3COOH.
08. (UECE) A amônia tem sido usada desde 1860, como agente refrigerante, menos nocivo que os CFCs; quando em solução aquosa, é conhecida como amoníaco. Sobre as propriedades e a estrutura do amoníaco, marque a afirmação verdadeira.
- Não é solvente de compostos iônicos.
- É uma base de Brönsted-Lowry.
- Sua molécula tem momento dipolar zero.
- Apresenta geometria trigonal do tipo sp2.
09. (UECE) Uma das formas de combater a azia, devido o excesso de produção de ácido clorídrico pelo organismo, é usar o leite de magnésia que possui caráter básico, que é um antiácido estomacal. O leite de magnésia reage com o ácido clorídrico, existente no estômago, formando um sal, neutralizando, assim, o excesso de ácido que provoca a acidez (azia) estomacal. Assinale a afirmação verdadeira.
- O leite de magnésia possui em sua composição o Mg(OH)2.
- A fórmula química do sal formado nesta reação é Mg(OH)Cl.
- O leite de magnésia apresenta pH menor do que 7.
- A equação química correta desta reação é Mg(OH)3 + 3HCl → MgCl3 + 3H2O.
10. (UDESC) O uso do calcário é importante para a correção da acidez do solo. Assinale a alternativa que representa a reação de neutralização da acidez do solo pelo calcário.
- CaCO3(s) + 2 H+(aq) → Ca2+(aq) + H2O(l) + CO2(g)
- CaCO3(s) + H+(aq) → Ca2+(aq) + H2O(l) + CO2(g)
- CaCO3(s) + OH-(aq) → Ca(OH)2 + CO2(g)
- CaCO3(s) + 2 OH-(aq) → Ca(OH)2 + CO2(g)
- CaCO3(s) + 2 H+(aq) → CaO(s) + H2O(l) + CO2(g)