Deslocamento de Equilíbrio: Princípio de Le Chatelier
Lista de 10 exercícios de Química com gabarito sobre o tema Deslocamento de Equilíbrio: Princípio de Le Chatelier com questões de Vestibulares.
Você pode conferir as videoaulas, conteúdo de teoria, e mais questões sobre o tema Deslocamento de Equilíbrio: Princípio de Le Chatelier.
01. (UDESC) O princípio de Le Chatelier diz: “Quando uma perturbação exterior for aplicada a um sistema em equilíbrio dinâmico o equilíbrio tende a se ajustar, para minimizar o efeito da perturbação”. Observe a reação química abaixo.
2 HCℓ (g) + I2 (g) ⇌ 2 HI (g) + Cℓ2 (g)
Em relação a essa reação química, é correto afirmar:
- Com o aumento da pressão o equilíbrio se desloca para o sentido de formação do produto.
- O equilíbrio se desloca no sentido de formação do produto, com o aumento da concentração HI (g).
- Com o aumento da pressão o equilíbrio se desloca para o sentido de formação dos reagentes.
- Com o aumento da pressão não ocorre deslocamento do equilíbrio da reação.
- Quando o gás I2 for consumido, o equilíbrio não se altera.
Resposta: D
Resolução:
02. (PUC-RJ) Podemos afirmar que o equilíbrio químico da reação de obtenção de cloreto de hidrogênio a partir dos gases hidrogênio e cloro, dada abaixo,
H2 (g) + cℓ (g) ⇌ 2 HCℓ (g)
pode ser deslocado no sentido da formação do produto pelo seguinte recurso:
- aumentando-se a pressão do sistema.
- diminuindo-se a pressão do sistema.
- diminuindo-se a pressão parcial de cℓ2.
- aumentando-se a pressão parcial de cℓ2.
- adicionando-se um catalisador ao meio reacional.
Resposta: D
Resolução:
03. (Ufscar) Em 1912, o químico alemão Fritz Haber desenvolveu um processo para sintetizar amônia diretamente dos gases nitrogênio e hidrogênio. Este processo é muito importante economicamente, porque a amônia é bastante utilizada, por exemplo, na indústria de fertilizantes. Considere a reação em equilíbrio químico num sistema fechado:
N2 (g) + 3 H2 (g) ⇌ 2 NH3 (g)
Mantendo-se a temperatura constante, algumas modificações podem ser realizadas nesse sistema:
I. introdução de N2 (g);
II. aumento da pressão do sistema;
III. adição de catalisador.
As modificações que irão provocar o deslocamento do equilíbrio, favorecendo a formação de NH3, são:
- I e II, apenas.
- I e III, apenas.
- III, apenas.
- II e III, apenas.
- I, II e III.
Resposta: A
Resolução:
04. (Unesp) Dada a reação exotérmica:
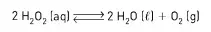
a alteração que favorece a formação dos produtos é a elevação da:
- temperatura.
- pressão parcial de 02.
- concentração de H20.
- pressão.
- concentração de H202.
Resposta: E
Resolução:
05. (PUC-MG) Indique a ação que não desloca um equilíbrio químico do tipo A (g) + B (s) ⇌ C (s) + energia:
- adição de um catalisador.
- adição de A (g).
- mudança da pressão.
- mudança da temperatura.
Resposta: A
Resolução:
06. (Uerj) Hidrogênio e iodo, ambos em fase gasosa, foram misturados em condições reacionais adequadas. A reação, em estado de equilíbrio, é representada por:
H2(g) + I2(g) + calor ⇌ 2 HI(g) K = 50
Em seguida, quatro modificações independentes foram impostas a esse sistema:
1 - aumento da temperatura;
2 - aumento da pressão;
3 - diminuição da concentração de I2;
4 - diminuição da concentração de H2;
A modificação que causa aumento no valor da constante de equilíbrio K é a indicada pelo seguinte número:
- 1
- 2
- 3
- 4
Resposta: A
Resolução:
07. (UTFPR) O argilomineral caulinita é comum em solos brasileiros. Esse argilomineral tem a capacidade de trocar cátions de sua estrutura por cátions da solução do solo. A reação iônica pode ser representada pela equação a seguir:
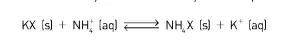
onde X representa o argilomineral caulinita. Se adicionarmos no solo uma solução aquosa de um adubo contendo nitrato de amônia, o que ocorre com o equilíbrio da reação?
- Desloca o equilíbrio para o lado do NH44 (aq).
- O valor da sua constante diminui.
- Desloca o equilíbrio para o lado do K+ (aq).
- O valor da sua constante aumenta.
- Permanece inalterado
Resposta: C
Resolução:
08. (UFSJ) A equação química abaixo representa a dissociação do PCℓ5.
PCℓ5 (g) ⇌ PCℓ3 (g) + Cℓ2 (g)
Para deslocar o equilíbrio para a direita, deve-se:
- adicionar um catalisador
- diminuir a pressão do sistema.
- diminuir a concentração de PCℓ5
- aumentar a concentração de Cℓ2
Resposta: B
Resolução:
09. (UDESC) Considere a seguinte reação química em equilíbrio:
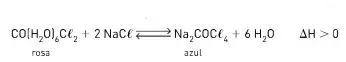
Essa equação representa a reação química na qual se baseiam alguns objetos decorativos que indicam alteração no tempo, principalmente com relação a mudanças na umidade relativa do ar. A superfície do objeto é revestida com sais a base de cloreto de cobalto (II). que apresenta coloração azul.
Com relação a esse equilíbrio, assinale a alternativa correta.
- A diminuição da temperatura, juntamente com o aumento da umidade, desloca o equilíbrio para a direita, tornando azul a superfície do objeto.
- O aumento da umidade faz com que a concentração dos íons cloreto diminua, deslocando assim o equilíbrio para a direita.
- O aumento da umidade do ar faz com que o equilíbrio se desloque para a esquerda, tornando rosa a cor do objeto.
- A diminuição da temperatura, mantendo a umidade constante, torna o objeto azul.
- O aumento da temperatura, mantendo a umidade constante, faz com que haja evaporação da água da superfície do objeto, tornando-o rosa.
Resposta: C
Resolução:
10. (UFSM) A maçã é apreciada pelos cantores, pois ajuda na limpeza das cordas vocais. O aroma da maçã pode ser imitado adicionando-se acetato de etila, CH3COOCH2CH3, aos alimentos. O acetato de etila pode ser obtido a partir da reação de esterificação:
Na temperatura de 25 ºC, o valor da constante de equilíbrio, Kc, é 4,0. Marque verdadeira (V) ou falsa (F) nas seguintes afirmações:
() A adição de acetato de etila aumenta a Kc.
() A adição de um catalisador diminui a Kc.
() A adição de acetato de etila desloca o equilíbrio no sentido de formação dos reagentes.
() A adição de ácido acético não desloca o equilíbrio.
() A adição de ácido acético não altera a Kc.
A sequência correta é:
- F - F - V - F -V
- V - V - F - F -V
- F - V - V - V - F
- V - F - F - F - V
- F - V - F - V - F
Resposta: A
Resolução: