Termoquímica
Lista de 10 exercícios de Química com gabarito sobre o tema Termoquímica com questões de Vestibulares.
Você pode conferir as videoaulas, conteúdo de teoria, e mais questões sobre o tema Termoquímica .
1. (UFPE) Considere as afirmações abaixo:
1. A areia molhada possui entropia maior que a areia seca.
2. A condensação do vapor d’água é um processo exotérmico.
3. A fusão de gelo é um processo endotérmico.
4. A evaporação da água é um processo endotérmico.
Qual(is) da(s) afirmação(ões) acima MELHOR explica(m) o fato de que, numa praia de Recife, PE, a areai molhada é mais fria que a areia seca?
- 1 e 3 apenas.
- 2 e 3 apenas.
- 4 apenas
- 3 apenas
- 2 apenas
Resposta: C
Resolução:
2. (Unitau) Na pizzaria, há cartazes dizendo “Forno a lenha”. A reação que ocorre deste forno para assar a pizza é
- explosiva
- exotérmica
- endotérmica
- hidroscópica
- catalisada
Resposta: B
Resolução:
3. (Fuvest) A oxidação de açúcares no corpo humano produz ao redor de 4,0 quilocalorias por grama de açúcar oxidado. A oxidação de um décimo de mol de glicose (C6H12O6) vai produzir aproximadamente:
Massas atômicas: H = 1,0; C = 12; O = 16;
- 40 kcal
- 50 kcal
- 60 kcal
- 70 kcal
- 80 kcal
Resposta: D
Resolução:
4. (PUC-MG) Sejam dadas as equações termoquímicas, todas a 25 ºC e 1 atm:
I- H2(g)+ ½ O2(g) →H2O(l) ∆H = -68,3 Kcal/mol
II- 2Fe(s)+ 3/2 O2(g)→Fe2O3(s) ∆H = -196,5 Kcal/mol
III- 2Al(s)+ 3/2 O2(g)→Al2O3(s) ∆H = -399,1 Kcal/mol
IV - C(grafite)+ O2(g)→ CO2(g) ∆H = -94,0 Kcal/mol
V- CH4(g) + O2(g) → CO2(g)+ H2O(l) ∆H = -17,9 Kcal/mol
Exclusivamente sob o ponto de vista energético, das reações acima, a que você escolheria como fonte de energia é:
- I
- II
- III
- IV
- V
Resposta: C
Resolução:
5. (UFBA) Em relação aos aspectos energéticos envolvidos nas transformações químicas, pode-se afirmar:
- a queima da parafina de uma vela exemplifica um processo endotérmico.
- a vaporização da água de uma piscina pela ação da luz solar exemplifica um processo endotérmico.
- a combustão do álcool hidratado em motores de automóveis exemplifica um processo endotérmico.
- a formação de um iceberg a partir da água do mar exemplifica um processo endotérmico.
- o valor de ΔH de uma transformação depende exclusivamente do estado físico dos reagentes.
Resposta: B
Resolução:
6. (Unesp) Ozonizador é um aparelho vendido no comércio para ser utilizado no tratamento da água. Nesse aparelho é produzido ozônio (O3) a partir do oxigênio do ar (O2), que mata os micro-organismos presentes na água. A reação de obtenção do ozônio a partir do oxigênio pode ser representada pela equação:
3 O2(g) ↔ 2 O3(g) ΔH = +284 kJ
Com base nessa equação, e considerando a transformação de 1000 g de O2(g) em O3(g), a quantidade de calor envolvida na reação é:
- 2958,33 kJ e a reação é endotérmica.
- 1479,16 kJ e a reação é exotérmica.
- 739,58 kJ e a reação é exotérmica.
- 369,79 kJ e a reação é endotérmica.
- 184,90 kJ e a reação é endotérmica.
Resposta: A
Resolução:
7. (UFRS) Considere as transformações a que é submetida uma amostra de água, sem que ocorra variação da pressão externa:
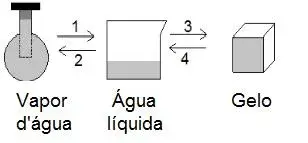
Pode-se afirmar que:
- as transformações 3 e 4 são exotérmicas.
- as transformações 1 e 3 são endotérmicas.
- a quantidade de energia absorvida em 3 é igual à quantidade liberada em 4.
- a quantidade de energia liberada em 1 é igual à quantidade liberada em 3.
- a quantidade de energia liberada em 1 é igual à quantidade absorvida em 2.
Resposta: E
Resolução:
08. (Puccamp - SP) Considere as seguintes equações termoquímicas:
I. 3 O2(g) → 2 O3(g) ∆H1 = +284,6 kJ
II. 1 C(grafita) + 1 O2(g)→ 1 CO2(g) ∆H2 = -393,3 kJ
III. 1 C2H4(g) + 3 O2(g) → 2 CO2(g) + 2H2O(l) ∆H3 = -1410,8 kJ
IV. 1 C3H6(g) + 1 H2(g) → 1 C3HO8(g) ∆H4 = -123,8 kJ
V. 1 I(g) → 1/2 I2(g) ∆H5 = -104,6 kJ
Qual é a variação de entalpia que pode ser designada calor de formação ou calor de combustão?
- ∆H1.
- ∆H2.
- ∆H3.
- ∆H4.
- ∆H5.
Resposta: B
Resolução:
09. (PUC-MG) Sejam dadas as equações termoquímicas, todas a 25 ºC e 1 atm:
I- H2(g)+ ½ O2(g) →H2O(l) ∆H = -68,3 Kcal/mol
II- 2Fe(s)+ 3/2 O2(g)→Fe2O3(s) ∆H = -196,5 Kcal/mol
III- 2Al(s)+ 3/2 O2(g)→Al2O3(s) ∆H = -399,1 Kcal/mol
IV - C(grafite)+ O2(g)→ CO2(g) ∆H = -94,0 Kcal/mol
V- CH4(g) + O2(g) → CO2(g)+ H2O(l) ∆H = -17,9 Kcal/mol
Exclusivamente sob o ponto de vista energético, das reações acima, a que você escolheria como fonte de energia é:
- I
- II
- III
- IV
- V
Resposta: C
Resolução:
10. (OSEC) Analise as afirmativas abaixo:
I. Entalpia (ΔH) pode ser conceituada como a energia global de um sistema.
II. Uma reação exotérmica apresenta ΔH positivo.
III. O calor de reação de um processo químico será dado por ΔH.
- somente I é correta
- somente II é correta
- somente III é correta
- as afirmativas I e II são corretas
- as afirmativas I e III são corretas.
Resposta: E
Resolução: