ITA 2023:
Gabarito: E
49. (ITA) Em uma titulação, 100 mL de uma solução de um ácido monoprótico fraco, cuja constante de ionização é igual a 10⁻⁹, são neutralizados com 25 mL de uma solução 0,5 mol L⁻¹ de hidróxido de sódio.
Assinale a opção que apresenta o pH no ponto de equivalência da titulação.
- 9,0.
- 9,5.
- 10,0.
- 10,5.
- 11,0.
Gabarito: C
50. (ITA) Sabe-se que a constante de velocidade (k) de uma reação é função da temperatura (T) conforme a Lei de Arrhenius:
em que A é o fator de frequência e Ea é a energia de ativação. Em um estudo cinético, observou-se que a velocidade de uma determinada reação aumenta 1000 vezes quando a temperatura do meio reacional aumenta de 400 K para 500 K, permanecendo constantes todos os demais parâmetros iniciais.
Assinale a opção que apresenta a energia de ativação desta reação, em kcal mol⁻¹, considerando que A e Ea não dependem da temperatura.
- 7,3.
- 17,3.
- 27,3.
- 37,3.
- 47,3.
Gabarito: B
51. (ITA) Considere as seguintes afirmações relacionadas a átomos e íons atômicos no estado gasoso:
I. A afinidade eletrônica do átomo de oxigênio é maior do que a do ânion O–.
II. A energia de ionização do átomo de oxigênio é maior do que a do ânion O²⁻.
III. O raio atômico do átomo de oxigênio é maior do que o do ânion O⁻.
IV. O átomo de oxigênio tem maior afinidade eletrônica e menor energia de ionização do que o átomo de nitrogênio.
Das afirmações I a IV, acima destacadas, são CORRETAS
- apenas I e II.
- apenas I, II e IV.
- apenas I e III.
- apenas II, III e IV.
- apenas III e IV.
Gabarito: D
52. (ITA) Considere que as curvas (I) e (II) representam uma mesma reação química em fase gasosa, mas em diferentes condições.
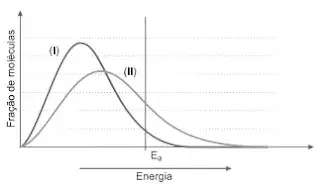
Sabendo que Ea é a energia de ativação, é CORRETO afirmar que
- em (II) a reação ocorre na presença de um catalisador.
- a reação é endotérmica.
- a reação é de primeira ordem.
- a temperatura em (I) é menor do que em (II).
- a constante de velocidade da reação em (I) é maior do que em (II).
Gabarito: D
53. (ITA) Considere os seguintes compostos:

Qual(is) dos compostos acima forma(m) comumente polímeros de condensação?
- Apenas I e II.
- Apenas I e III.
- Apenas II e III.
- Apenas II e IV.
- Apenas IV.
Gabarito: A
54. (ITA) Um eletrólito genérico BA2 ioniza em solução aquosa, de acordo com a equação química:
BA2 ⇆ B²⁺ + 2A⁻
Considere duas soluções aquosas, preparadas com as mesmas quantidades desse eletrólito, nas seguintes condições de equilíbrio:
Solução 1: Volume V1, temperatura T1 e grau de ionização do eletrólito α1.
Solução 2: Volume V2 = 2V1, temperatura T2 e grau de ionização do eletrólito α2 = α1.
Com base nessas informações, assinale a opção que relaciona corretamente a constante de equilíbrio da ionização do eletrólito na solução 2, K2, com a constante de equilíbrio na solução 1, K1.
- K2 = 0,25K1.
- K2 = 0,5K1.
- K2 = K1.
- K2 = 2K1.
- K2 = 4K1.
Gabarito: A
55. (ITA) Um sistema contendo oxigênio atômico (na forma do isótopo estável mais abundante)hidrogênio atômico (na forma dos dois isótopos mais estáveis) é colocado a reagir em duas condições diferentes, levando à formação de produtos únicos e distintos, X e Y, respectivamente.
Considere que X e Y correspondem a moléculas neutras, estáveis e que obedecem à regra do octeto, e que a massa molar média de X é menor do que a de Y.
Assinale a opção que relaciona corretamente as possíveis razões entre as massas de hidrogênio e de oxigênio nas moléculas que constituem X e Y.
- X: 1/8, 3/16 e 1/4,
Y: 1/16, 3/32 e 1/8. - X: 1/8, 3/16 e 1/4,
Y: 1/24, 1/16 e 1/12. - X: 1/16, 3/32 e 1/8,
Y: 1/8, 3/16 e 1/4. - X: 1/16, 1/8 e 1/4,
Y: 1/32, 1/16 e 1/8. - X: 1/24, 1/16 e 1/12,
Y: 1/8, 3/16 e 1/4.
Gabarito: C
56. (ITA) Em uma determinada temperatura, uma mistura gasosa contendo as substâncias X2, Y2 e XY é adicionada a um recipiente de 1 L, nas concentrações, em mol L⁻¹, de 0,4, 0,4 e 0,8, respectivamente.
A equação química que representa a reação, cuja constante de equilíbrio é igual a 16, é dada por
X2 + Y2 ⇆ 2XY.
Assinale a opção que contém a concentração aproximada, em mol L⁻¹, do produto XY, após a reação atingir o equilíbrio.
- 0,5.
- 0,8.
- 1,1.
- 2,2.
- 2,7.
Gabarito: E
57. (ITA) Considere que valores maiores de energia de hidratação são observados para íons com menor tamanho e maior carga. Com base nessa informação, são feitas as seguintes comparações entre a energia de hidratação dos pares de íons abaixo.
I. Li⁺ > K⁺.
II. B³⁺ > Al³⁺.
III. Sr²⁺ < Ca²⁺.
IV. Ga³⁺ > Ca²⁺.
V. S²⁻ > Se²⁻.
Das comparações I a V, acima destacadas, são CORRETAS
- apenas I e II.
- apenas I, II e IV.
- apenas II, III e V.
- apenas III, IV e V.
- todas.
Gabarito: B
58. (ITA) Considere as seguintes afirmações sobre características de óleos e gorduras.
I. Em temperatura ambiente, óleos são líquidos e gorduras são sólidas.
II. Óleos são ricos em ésteres de ácidos graxos insaturados, ao passo que gorduras possuem predominância de ésteres de ácidos graxos saturados.
III. A reação entre óleos ou gorduras com hidróxido de sódio (NaOH) ou hidróxido de potássio (KOH) produz sabão.
IV. Quanto maior é o índice de saponificação, maior a massa molar média do triglicerídeo do óleo ou da gordura. Por índice de saponificação, entenda-se a massa de KOH, em mg, necessária para saponificar 1 g de óleo ou de gordura.
Das afirmações I a IV, acima destacadas, são CORRETAS
- apenas I e II.
- apenas I, II e III.
- apenas III e IV.
- apenas I e IV.
- todas.
Gabarito: A
59. (ITA) Considere as seguintes afirmações relativas a ácidos.
I. O ácido fosfórico possui hidrogênios que podem ser substituídos por grupos orgânicos para a formação de ésteres.
II. O ácido fosfórico pode produzir três cátions do tipo hidroxônio em água.
III. A ionização do ácido clorídrico aumenta a condutividade elétrica de soluções aquosas.
IV. O grau de ionização de ácidos é a relação entre o número de moléculas dissolvidas e o número total de moléculas.
Das afirmações I a IV, acima destacadas, são CORRETAS
- apenas I, II e III.
- apenas II e III.
- apenas II e lV.
- apenas III e IV.
- todas.
60. (ITA) Os seguintes diagramas representam diferentes estados de equilíbrio de uma reação exotérmica do tipo A2(g) + B2(g) ⇆ 2AB(g).
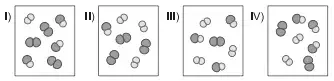
Assinale a opção que contém a afirmação CORRETA.
- Se a constante de equilíbrio da reação, KC, em uma determinada temperatura, é igual a 3, apenas o diagrama (I) representa o sistema no equilíbrio.
- Os diagramas (II) e (IV) podem representar a situação da reação em equilíbrio em duas temperaturas diferentes, com TII > TIV.
- Se todos os diagramas representam a reação em equilíbrio, o diagrama (III) representa a reação com a menor constante de equilíbrio.
- Se a pressão for reduzida à metade pela duplicação do volume, em temperatura constante, os diagramas (II) e (III) representam a reação em equilíbrio para estado inicial e final, respectivamente, desse processo, com VII = 2VIII.
- Se cada símbolo que representa uma molécula nos diagramas equivale a 0,20 mol e se o volume do recipiente é 1,0 L, a constante de equilíbrio da reação representada pelo diagrama (I) é 0,5.