FAMERP 2023: Química
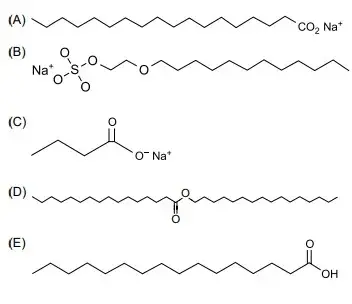
51. (FAMERP 2023) O sabão é formado por um sal de ácido graxo, apresenta uma extremidade hidrofílica (iônica) e outra lipofílica, que é uma longa cadeia linear e apolar. Essa constituição explica a ação tensoativa e emulsificante do sabão em solução aquosa, formando estruturas micelares em que a gordura é dispersa em água.
Um exemplo de estrutura que corresponde à de um sabão é:
52. (FAMERP 2023) O radioisótopo estrôncio-90 (⁹⁰Sr) é subproduto importante da fissão nuclear do ²³⁵U, fazendo parte do resíduo nuclear de reatores de usinas termonucleares. Esse isótopo foi um dos responsáveis pela contaminação do solo e da água nos arredores das usinas de Chernobil e Fukushima, após os acidentes nucleares ocorridos em 1986 e 2011, respectivamente.
O cátion ⁹⁰Sr²⁺, encontrado no solo nessas ocasiões, apresenta
- 40 prótons, 50 nêutrons e 38 elétrons.
- 38 prótons, 90 nêutrons e 40 elétrons.
- 45 prótons, 45 nêutrons e 43 elétrons.
- 38 prótons, 52 nêutrons e 36 elétrons.
- 90 prótons, 90 nêutrons e 92 elétrons.
Leia o texto para responder às questões 53 e 54.
A pólvora negra é um explosivo bastante comum e antigo, formado por uma mistura sólida de nitrato de potássio (KNO3), carvão (C) e enxofre (S).
53. (FAMERP 2023) Os componentes de uma amostra de pólvora negra foram isolados a partir do procedimento esquematizado a seguir.
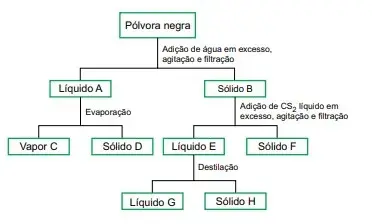
O quadro apresenta a solubilidade dos componentes da pólvora negra em água e em dissulfeto de carbono (CS2).

No processo de separação apresentado, os sólidos D, F e H são, respectivamente:
- C, KNO3 e S
- KNO3, C e S
- KNO3, S e C
- C, S e KNO3
- S, C e KNO3
54. (FAMERP 2023) Na ignição da pólvora negra ocorre a transformação química representada a seguir:
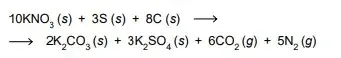
O fenômeno representado é uma reação de oxirredução em que
- KNO3 e S são os oxidantes, enquanto C é o redutor.
- KNO3 é o oxidante, C é o redutor, enquanto o S não participa da transferência de elétrons.
- KNO3 é o oxidante, enquanto C e S atuam como redutores.
- C e S são os oxidantes, enquanto KNO3 é o redutor.
- C é o oxidante, enquanto KNO3 e S atuam como redutores.
55. (FAMERP 2023) A combustão completa do acetileno (C2H2) gera exclusivamente gás carbônico (CO2) e água (H2O), conforme a reação representada:

Devido ao grande desprendimento de energia nesse processo, o acetileno é utilizado como combustível em maçaricos para corte de metais ou fabricação de objetos de vidro (solda oxiacetilênica).
Considere 14,0 L de mistura em quantidades estequiométricas dos gases acetileno e oxigênio armazenada a 20 ºC e 1,5 atm. Após a completa combustão, o volume máximo de gás carbônico recolhido nessa mesma condição de temperatura e pressão será
- 14,0 L.
- 12,0 L.
- 4,0 L.
- 28,0 L.
- 8,0 L.
56. (FAMERP 2023) A tabela nutricional de determinado refrigerante indica a presença de 21 g de sacarose (C12H22O11) a cada 200 mL da bebida. Considerando que a massa molar da sacarose é 342 g/mol, a concentração desse soluto no refrigerante é de, aproximadamente,
- 0,2 mol/L.
- 1,0 mol/L.
- 0,5 mol/L.
- 0,3 mol/L.
- 0,1 mol/L.
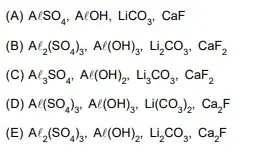
57. (FAMERP 2023) A carga comum dos íons mononucleares de elementos representativos é uma propriedade periódica e está relacionada com a distribuição eletrônica de cada elemento. As fórmulas de alguns ânions polinucleares estão representadas na tabela.
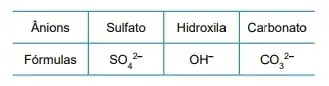
A partir da Classificação Periódica e das informações fornecidas, as fórmulas dos compostos iônicos sulfato de alumínio, hidróxido de alumínio, carbonato de lítio e fluoreto de cálcio são, respectivamente,
58. (FAMERP 2023) Para determinar a fórmula de um hidrocarboneto gasoso, uma amostra de 0,6 L dessa substância foi completamente queimada na presença de excesso de gás oxigênio, gerando exclusivamente 4,4 g de gás carbônico (CO2) e 1,8 g de água (H2O). Considere que, nas condições em que essa determinação foi realizada, o volume molar dos gases é igual a 24,0 L/mol.
A fórmula molecular do hidrocarboneto em questão é:
- C2H6
- C2H4
- C3H8
- C4H8
- CH4
59. (FAMERP 2023) O comprimento de ligação é a distância entre os núcleos de dois átomos ligados e está relacionado ao tamanho dos átomos (raio atômico) e à quantidade de pares de elétrons envolvidos na ligação.
Considere a molécula de etanoato de metila, cuja fórmula estrutural é:
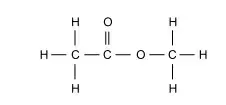
Os comprimentos das ligações C–H, C–C, C–O e C =O, expressos em picômetros (pm), são, respectivamente,
- 110, 154, 143, 122.
- 154, 110, 122, 143.
- 110, 122, 143, 154.
- 143, 122, 154, 110.
- 122, 143, 110, 154.
60. (FAMERP 2023) O estudo cinético de determinado processo químico permitiu a construção de coordenadas de reação como a ilustrada no gráfico.
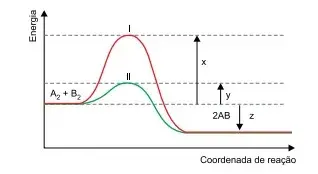
De acordo com a análise do gráfico, verifica-se que:
- a reação ocorre pelo caminho II devido à presença de um catalisador liberando energia, diferentemente do caminho I, que é endotérmico.
- quando a reação ocorre pelo caminho I, o reagente A2 é consumido mais rapidamente do que quando ocorre pelo caminho II.
- a reação é endotérmica, sendo absorvida a energia dada por (x – z) por mol de A2 consumido.
- devido à atuação do catalisador, o caminho II apresenta menor energia de ativação, igual a y, do que o caminho I, cuja energia de ativação é dada por x.
- a reação é exotérmica e libera energia dada por (x + z) por mol de A2 consumido.
| Gabarito |
|---|
| 51. A | 52. D | 53. B | 54. C | 55. E |
| 56. D | 57. B | 58. D | 59. A | 60. D |