Santa Casa 2023:
Gabarito: D
51. (Santa Casa) O cloreto de nitrila (ClNO2) é um composto formado em ambiente marinho. Em pressão ambiente ele apresenta temperatura de fusão –30 ºC e de ebulição 5 ºC. A figura representa uma curva de aquecimento desse composto a 1 atm
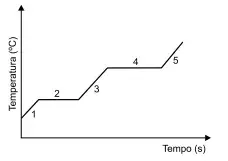
Na curva de aquecimento do cloreto de nitrila, a região correspondente à temperatura de 298 K está indicada pelo número
- 2
- 3
- 1
- 5
- 4
Gabarito: D
51. (Santa Casa) O cloreto de nitrila (ClNO2) é um composto formado em ambiente marinho. Em pressão ambiente ele apresenta temperatura de fusão –30 ºC e de ebulição 5 ºC. A figura representa uma curva de aquecimento desse composto a 1 atm

Na curva de aquecimento do cloreto de nitrila, a região correspondente à temperatura de 298 K está indicada pelo número
- 2
- 3
- 1
- 5
- 4
Gabarito: E
52. (Santa Casa) Uma das teorias que explicam a origem dos elementos químicos em processos estelares apresenta reações que envolvem fusão nuclear entre isótopos dos elementos leves.
Uma dessas reações é a da formação do isótopo lítio-7 representada na equação a seguir.

Nessa reação, o nuclídeo representado por X tem número de prótons igual a ________ e quantidade de nêutrons igual a ________.
As lacunas do texto são preenchidas, respectivamente, por
- 1 e 3.
- 1 e 1.
- 2 e 3.
- 2 e 1.
- 1 e 2.
Gabarito: B
53. (Santa Casa) A nitroglicerina (C3H5N3O9) é uma medicação empregada na forma injetável em diversas terapias cardiológicas. Ela é disponibilizada para uso hospitalar em ampolas de 10 mL, em solução com concentração 5 mg/mL.
Para uso intravenoso, deve-se preparar uma infusão com diluição de uma ampola de nitroglicerina em soro fisiológico até o volume final de 500 mL.
Nessa solução para infusão, a concentração de nitroglicerina é igual a
- 1 g/L.
- 0,1 g/L.
- 0,05 g/L.
- 0,5 g/L.
- 0,01 g/L.
Gabarito: A
54. (Santa Casa) Analise o quadro que apresenta as fórmulas estruturais de substâncias líquidas, em temperatura ambiente, que são empregadas como solventes em sínteses orgânicas.
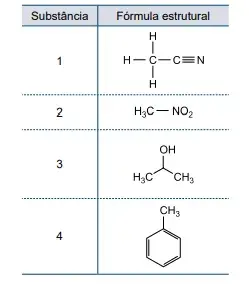
Dentre as substâncias apresentadas no quadro, aquelas que, quando misturadas, apresentam interação por ligação de hidrogênio são as de números
- 2 e 3.
- 1 e 4.
- 1 e 2.
- 2 e 4.
- 3 e 4.
Gabarito: B
55. (Santa Casa) Resíduos de alimentos podem ser transformados em fonte de energia por meio de fermentação anaeróbia em biodigestores. Nesse processo ocorre a formação de uma mistura de gases rica em metano (CH4) que contém também vapor de água (H2O), amônia (NH3), sulfeto de hidrogênio (H2S) e dióxido de carbono (CO2). Dentre as moléculas gasosas formadas nesse processo, aquela que apresenta ângulo de ligação de 180º é a de
- água.
- dióxido de carbono.
- sulfeto de hidrogênio.
- metano.
- amônia.
Gabarito: C
56. (Santa Casa) Um compartimento selado, de volume invariável é preenchido, a 20 ºC, com uma mistura dos gases propano (C3H8) e oxigênio (O2) em proporção estequiométrica para reação de combustão completa. Uma faísca é fornecida à mistura gasosa ocasionando a reação de combustão. O volume do líquido formado nessa reação é desprezível em relação ao volume total do compartimento. Denominando-se P1 a pressão da mistura gasosa inicial, a pressão gasosa no interior do compartimento após a reação de combustão completa (pressão final), medida a 20 ºC, é igual a
- 0,2 × P1.
- 5 × P1.
- 0,5 × P1.
- 2 × P1.
- 1 × P1.
Gabarito: A
57. (Santa Casa) A figura apresenta três béqueres contendo, separadamente, volumes iguais de água destilada (líquido 1), solução aquosa de fluoreto de sódio (NaF) 1 mol/L (líquido 2) e solução aquosa de glicose (C6H12O6) 1 mol/L (líquido 3)
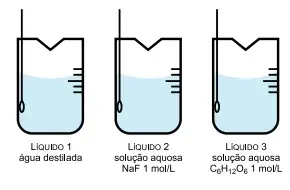
Considere que os três líquidos tenham sido mantidos à mesma temperatura de 60 ºC. Nessa condição, as pressões de vapor desses líquidos (PV1, PV2 e PV3) estão relacionadas pela expressão matemática:
- PV1 > PV3 > PV2
- PV1 > PV2 = PV3
- PV2 > PV3 > PV1
- PV2 > PV1 > PV3
- PV1 > PV2 < PV3
Gabarito: C
58. (Santa Casa) O boro é um micronutriente essencial para o crescimento de vegetais, porém pouco abundante nos solos brasileiros. Para a preparação de cultivos, os agricultores pulverizam caldas de ácido bórico no solo. O ácido bórico (H3BO3) é um ácido monoprótico com massa molar 61,8 g/mol e constante de ionização Ka = 5 × 10–10 a 25 ºC.
Uma calda foi preparada colocando-se 12,36 kg de ácido bórico em um compartimento, adicionando-se água até atingir a capacidade volumétrica de 1 m³.
Considerando-se que a água empregada apresentava pH próximo de 7, o pH da calda preparada a 25 ºC era próximo de
- 9.
- 3.
- 5.
- 2.
- 1
Gabarito: D
59. (Santa Casa) As equações de reação a seguir referem-se à formação de dois polímeros empregados pela indústria de alimentos em embalagens: o isopor, usado para a confecção de bandejas e caixas e o PET, usado para a confecção de garrafas.
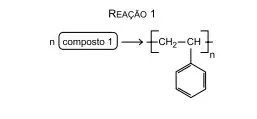
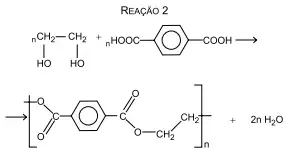
A fórmula estrutural do composto 1 e a classificação da reação 2 são
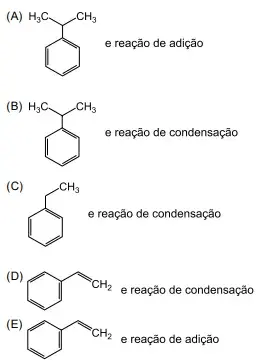
Gabarito: B
60. (Santa Casa) Em um experimento para identificação de compostos orgânicos foi empregado o chamado “reagente de Tollens”, uma solução aquosa de hidróxido de diaminprata, Ag(NH3)2OH, em que a prata encontra-se no estado de oxidação +1.
Em um tubo de ensaio, esse reagente foi misturado a um composto orgânico oxigenado, o tubo foi aquecido e, como resultado, observou-se a formação de um espelho de prata metálica nas suas paredes internas. A reação química ocorrida está representada pelo esquema a seguir:
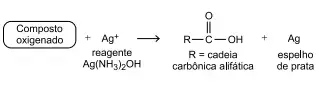
Nesse experimento, o composto orgânico oxigenado que reagiu apresentava o grupo funcional
- éter, que foi oxidado.
- aldeído, que foi oxidado.
- álcool, que foi reduzido.
- cetona, que foi oxidado.
- éster, que foi reduzido.