Química Geral III
Lista de 15 exercícios de Química com gabarito sobre o tema Química Geral III com questões da Vestibulares Militares
Você pode conferir as videoaulas, conteúdo de teoria, e mais questões sobre o tema Química Geral III.
01. (EsPCEx) Considere dois elementos químicos cujos átomos fornecem íons bivalentes isoeletrônicos, o cátion X2+ e o ânion Y2-.
Pode-se afirmar que os elementos químicos dos átomos X e Y referem-se, respectivamente, a
- 20Ca e 34Se
- 38Sr e 8O
- 38Sr e 16S
- 20Ca e 8O
- 20Ca e 16S
02. (CN) A queima do magnésio(Mg) com o gás oxigênio emite uma luz branca (o flash das máquinas fotográficas), resultando no óxido de magnésio (MgO).
A equação dessa reação devidamente balanceada é
- Mg + O2 → MgO.
- 2Mg + O2 → 2MgO.
- 2Mg + O3 → Mg2O3.
- Mg + O → 2MgO.
- Mg2 + O2 → Mg2O.
03. (EsPCEx) O fosgênio é um gás extremamente venenoso, tendo sido usado em combates durante a Primeira Guerra Mundial como agente químico de guerra. É assim chamado porque foi primeiro preparado pela ação da luz do sol em uma mistura dos gases monóxido de carbono (CO) e cloro (Cl2), conforme a equação balanceada da reação descrita a seguir: CO (g) + Cl2(g) → COCl2 (g).
Em um reator foram dispostos 560 g de monóxido de carbono e 355 g de cloro. Admitindo-se a reação entre o monóxido de carbono e o cloro com rendimento de 100 % da reação e as limitações de reagentes, a massa de fosgênio produzida é de
Dados: - massas atômicas: C = 12 u ; Cl = 35,5 u; O = 16 u
- 228 g
- 495 g
- 654 g
- 832 g
- 928 g
04. (CN) Ao aquecer o iodo num béquer coberto com o vidro de relógio, após certo tempo observa-se que seus vapores ficaram roxos.
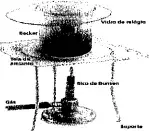
Esse fenômeno é uma mudança de estado físico chamada
- liquefação.
- fusão.
- sublimação.
- solidificação.
- ebulição.
05. (EsPCEx) Considerando a equação não balanceada da reação de combustão do gás butano descrita por C4H10 (g) + O2 (g) CO2 (g) + H2O (g) a 1 atm e 25 oC (condições padrão) e o comportamento desses como gases ideais, o volume de gás carbônico produzido pela combustão completa do conteúdo de uma botija de gás contendo 174,0 g de butano é:
Dados: Massas Atômicas: C = 12 u; O = 16 u e H = 1u;
Volume molar nas condições padrão=24,5 L·mol-1.
- 1000,4 L
- 198,3 L
- 345,6 L
- 294,0 L
- 701,1 L
06. (CN) Massa, extensão e impenetrabilidade são exemplos de propriedade
- funcionais.
- químicas.
- particulares.
- gerais.
- físicas.
07. (EsPCEx) Abaixo são fornecidos os resultados das reações entre metais e sais.
FeSO4(aq) + Ag(s) → não ocorre a reação
2 AgNO3(aq) + Fe(s) → Fe(NO3)2(aq) + 2 Ag(s)
3 Fe(SO4)(aq) + 2 Al(s) → Al2(SO4)3(aq) + 3 Fe(s)
Al2(SO4)3(aq) + Fe(s) → não ocorre a reação
De acordo com as reações acima equacionadas, a ordem decrescente de reatividade dos metais envolvidos em questão é:
- Al, Fe e Ag.
- Ag, Fe e Al.
- Fe, Al e Ag.
- Ag, Al e Fe.
- Al, Ag e Fe.
08. (CN) Considere as seguintes misturas heterogêneas de sólidos:
I - Amendoim torrado e suas cascas.
II - Serragem e limalha de ferro.
III - Areia e brita.
Assinale a opção que apresenta, respectivamente, os processos que permitem a separação das frações das misturas acima.
- Levigação, imantização e ventilação.
- Destilação simples, flotação e peneiração.
- Ventilação, flutuação e peneiração.
- Peneiração, separação magnética e flotação.
- Peneiração, ventilação e centrifugação.
09. (EsPCEx) A seguir são apresentadas as configurações eletrônicas, segundo o diagrama de Linus Pauling, nos seus estados fundamentais, dos átomos representados, respectivamente, pelos algarismos I, II, III e IV.
I- 1s² 2s² 2p6
II- 1s² 2s² 2p6 3s1
III- 1s² 2s² 2p6 3s²
IV- 1s² 2s² 2p6 3s² 3p5
Com base nessas informações, a alternativa correta é:
- O ganho de um elétron pelo átomo IV ocorre com absorção de energia.
- Dentre os átomos apresentados, o átomo I apresenta a menor energia de ionização.
- O átomo III tem maior raio atômico que o átomo II.
- O cátion monovalente oriundo do átomo II é isoeletrônico em relação ao átomo III.
- A ligação química entre o átomo II e o átomo IV é iônica.
10. (CN) Considere as seguintes misturas:
I - Enxofre em pó e lascas de ferro.
II - Água e sal de cozinha.
III - Sangue humano (glóbulos vermelhos e plasma).
Assinale a opção que permite, respectivamente, a separação das misturas acima
- Separação magnética, destilação fracionada e decantação.
- Separação magnética, destilação simples e destilação fracionada.
- Catação, destilação fracionada e decantação
- Peneiração, filtração e centrifugação.
- Separação magnética, destilação simples e centrifugação.
11. (EsPCEx) Os alunos de uma escola realizam experiências no laboratório de Química utilizando 8 substâncias diferentes. O experimento consiste em misturar quantidades iguais de duas dessas substâncias e observar o produto obtido.
O professor recomenda, entretanto, que as substâncias S1, S2 e S3 não devem ser misturadas entre si, pois produzem como resultado o gás metano, de odor muito ruim. Assim, o número possível de misturas diferentes que se pode obter, sem produzir o gás metano é
- 16
- 24
- 25
- 28
- 56
12. (EsPCEx) Podemos afirmar que, para um gás ideal, ao final de toda transformação cíclica,
- o calor total trocado pelo gás é nulo.
- a variação da energia interna do gás é nula.
- o trabalho realizado pelo gás é nulo.
- a pressão interna do gás diminui.
- o volume interno do gás aumenta.
13. (IME) Um isótopo de cromo, de massa atômica 54, constitui 53% da massa de um óxido formado exclusivamente pelo isótopo e por oxigênio. A partir dessa informação, pode-se estimar que a fórmula mínima do óxido e o calor específico do cromo-54 são:
- CrO3 e 0,12 cal/(g.oC)
- CrO3 e 0,18 cal/(g.oC)
- Cr2O6 e 0,12 cal/(g.oC)
- Cr2O3 e 0,16 cal/(g.oC)
- Cr4O e 0,18 cal/(g.oC)
14. (IME) O processo de deposição de filmes finos de óxido de índio-estanho é extremamente importante na fabricação de semicondutores. Os filmes são produzidos por pulverização catódica com radiofrequência assistida por campo magnético constante.
Considere as afirmativas abaixo:
I - O índio é um mau condutor de eletricidade.
II – O raio atômico do índio é maior que o do estanho.
III – A densidade do índio é menor que a do paládio.
IV – O ponto de fusão do índio é maior que o do gálio.
Analisando as afirmativas acima, conclui-se que
- todas estão corretas
- apenas a II e a III estão corretas.
- apenas a II, a III e a IV estão corretas.
- apenas a I e a III estão corretas.
- apenas a IV está correta.
15. (IME) Em 33,65 g de um sal de magnésio está presente 1 mol deste elemento. Sendo trivalente o ânion deste sal, é correto afirmar que a massa de 1 mol do ânion é
(Massa molar: Mg = 24,31 g/mol)
- 6,23 g
- 14,01 g
- 24,31 g
- 42,03 g
- 48,62 g