Cálculo Estequiométrico (EsPCEx)
Lista de 11 exercícios de Química com gabarito sobre o tema Cálculo Estequiométrico (EsPCEx) com questões da Vestibulares Militares
Você pode conferir as videoaulas, conteúdo de teoria, e mais questões sobre o tema Cálculo Estequiométrico (EsPCEx).
01. (ESPCEX - 2012) O quadro a seguir relaciona ordem, equação química e onde as mesmas ocorrem:
As equações químicas I, II, III e IV correspondem, nessa ordem, aos seguintes tipos de reação:
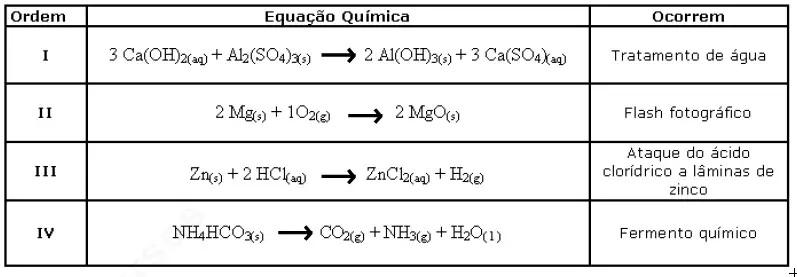
- I -síntese; II-análise; III-deslocamento e IV-dupla troca.
- I-dupla troca; II-síntese; III-deslocamento e IV-análise.
- I-análise; II-síntese; III-deslocamento e IV-dupla troca.
- I-síntese; II-análise; III-dupla troca e IV-deslocamento.
- I-deslocamento; II-análise; III-síntese e IV-dupla troca.
02. (ESPCEX - 2015) Em um reator foram dispostos 560 gramas de monóxido de carbono e 355 gramas de cloro. Admitindo-se a reação entre o monóxido de carbono e o cloro com rendimento de 100% da reação e as limitações de reagentes, a massa de fosgênio produzida é de:
- 228 g
- 497 g
- 654 g
- 832 g
- 928 g
03. (EsPCEx - 2012) O etino, também conhecido como acetileno, é um alcino muito importante na Química. Esse composto possui várias aplicações, dentre elas o uso como gás de maçarico oxiacetilênico, cuja chama azul atinge a temperatura em torno de 3000°C. A produção industrial do gás etino está representada abaixo, em três etapas, conforme as equações balanceadas:
ETAPA I: CaCO3(s) → CaO(s) + CO2(g)
ETAPA II: CaO(s) + C(grafite) → CaC2(s)+ CO(g)
ETAPA III: CaC2(s) + 2 H2O(g) → Ca(OH)2 (aq) + C2H2(g)
Considerando as etapas citadas e admitindo que o rendimento de cada etapa da obtenção do gás etino por esse método é de 100%, então a massa de carbonato de cálcio necessário para produzir 5,2g do gás etino (C2H2(g)) é:
- 20,0 g
- 18,5 g
- 16,0 g
- 26,0 g
- 28,0 g
04. (EsPCEx - 2016) A nitroglicerina é um líquido oleoso de cor amarelo-pálida, muito sensível ao choque ou calor. É empregada em diversos tipos de explosivos. Sua reação de decomposição inicia-se facilmente e gera rapidamente grandes quantidades de gases, expressiva força de expansão e intensa liberação de calor, conforme a equação da reação:
4 C3H5N3O9(l) → 6 N2(g) + 12 CO2(g) + 10 H2O(g) +O2(g).
Admitindo-se os produtos gasosos da reação como gases ideais, cujos volumes molares são iguais a 24,5 L, e tomando por base a equação a reação de decomposição da nitroglicerina, o volume total aproximado, em litros, de gases produzidos na reação de decomposição completade 454 g de nitroglicerina será de:
Dados: massa molar da nitroglicerina = 227 g/mol;
volume molar = 24,5 L/mol (25°C e 1 atm).
- 355,3 L
- 304,6 L
- 271,1 L
- 123,5 L
- 89,2 L
05. (ESPCEX – 2014) Considerando a equação não balanceada da reação de combustão do gás butano descrita por C4H10(g) + O2(g) → CO2(g) + H2O(g) a 1 atm e 25°C(condições padrão) e o comportamento desses como gases ideais, o volume de gás carbônico produzido pela combustão completa do conteúdo de uma botija de gás contendo 174,0 gramas de butano é:
- 1000,4 L
- 198,3 L
- 345,6 L
- 294,0 L
- 701,1 L
06. (ESPCEX - 2014) O ácido clorídrico reage com alguns metais. Ao reagir com o magnésio metálico, forma como produtos um gás inflamável/explosivo e um sal. Os nomes destes produtos formados são respectivamente:
- gás cloro e clorato de magnésio
- gás hidrogênio e clorato de magnésio
- gás oxigênio e cloreto de magnésio
- gás hidrogênio e cloreto de magnésio
- gás cloro e clorito de magnésio
07. (ESPCEX - 2016) Um mineral muito famoso, pertencente ao grupo dos carbonatos, e que dá origem a uma pedra semipreciosa é a malaquita, cuja fórmula é: Cu2(OH)2CO3 ou [CuCO3.Cu(OH)2]. Experimentalmente pode-se obter malaquita pela reação de precipitação que ocorre entre soluções aquosas de sulfato de cobre II e carbonato de sódio, formando um carbonato básico de cobre II hidratado, conforme a equação: 2 CuSO4(aq) + 2 Na2CO3(aq) + H2O(l) → CuCO3.Cu(OH)2(s) + 2 Na2SO4(aq) + CO2(g). Na reação de síntese da malaquita, partindo-se de 1060 g de carbonato de sódio e considerando-se um rendimento de reação de 90%, o volume de CO2 (a 25°C e 1 atm) e a massa de malaquita serão, respectivamente, de:
- 20,15 L e 114 g
- 42,65 L e 272 g
- 87,35 L e 584 g
- 110,25 L e 999 g
- 217,65 L e 1480 g
08. (ESPCEX – 2014) O cobre metálico é uma substância que possui elevado potencial de redução e no seu estado metálico sofre pouco em termos de oxidação frente a ácidos, não sendo oxidado pela maioria deles. Todavia, ele é oxidado na presença de ácido nítrico, conforme mostra a equação não balanceada de uma das possíveis reações:
Cu(s) + HNO3(aq) → Cu(NO3)2(aq) + NO(g) + H2O(l).
Após o balanceamento da equação com os coeficientes estequiométricos (menores números inteiros) a soma destes coeficientes será igual a:
- 14
- 18
- 20
- 24
- 26
09. (EsPCEx - 2017) A emissão de gases derivados do enxofre, como o dióxido de enxofre (SO2), pode ocasionar uma série de problemas ambientais e a destruição de materiais como rochas e monumentos à base de calcita (carbonato de cálcio). Essa destruição ocasiona reações com a emissão de outros gases, como o gás carbônico(CO2), potencializando o efeito poluente.
Considerando as equações das reações sucessivas a 27°C e 1 atm, admitindo-se os gases como ideais e as reações completas, o volume de CO2 produzido a partir da utilização de 2 toneladas de SO2 como reagente é, aproximadamente:
Dados: Constante dos gases ideais: R = 0,082 atm.L.mol-1.K-1;
Volume molar nas condições em que ocorreu a reação (27°C e 1 atm) = 24,6 L/mol.
SO2(g) + 1/2 O2(g) → SO3(g) (Equação I)
SO3(g) + H2O(ℓ) → H2SO4(ℓ) (Equação II)
H2SO4(ℓ) + CaCO3(s) → CaSO4(s) + H2O(ℓ) + CO2(g) (Equação III)
- 4,35 106 L de CO2.
- 2,25 106 L de CO2.
- 4,75 104 L de CO2.
- 5,09 103 L de CO2.
- 7,69 105 L de CO2.
10. (EsPCEx – 2018) Considere que a reação de cobre metálico com ácido nítrico diluído produz, nas CNTP, um volume gasoso de 181,6 L de óxido de nitrogênio II (NO), água e nitrato de cobre II. Nesse caso, a soma dos coeficientes estequiométricos da equação corretamente balanceada dessa reação completa e a massa de cobre consumida são, respectivamente:
- 18 e 1222 g
- 20 e 768 g
- 16 e 154 g
- 20 e 650 g
- 18 e 402 g
11. (ESPCEX) A densidade do carbono na forma de diamante é de 3,51 g/cm3. Se você tem um pequeno diamante cujo volume é de 0,027 cm3, quantos mols de carbono ele contém?
- 0,0079 mol
- 0,095 mol
- 10,80 mol
- 1,14 mol
- 0,016 mol